
músculo relaxado
O músculo pode ser comparado a uma máquina que transforma energia química em
trabalho, produzindo calor. Quando em atividade, pode alterar sua tensão e seu
comprimento. As propriedades fisiológicas dos músculos são diferentes nos diferentes
estados: relaxamento, início da contração, contração propriamente dita e retorno ao
relaxamento.
A força exercida pelo músculo na contração é medida pela unidade de tensão (P),
que permite a correção para o tamanho do músculo (medida pela área de maior secção
transversal do músculo em questão). O tamanho do músculo é expresso como uma fração
do comprimento do músculo em que ele é capaz de exercer maior tensão isométrica (lo)
.
Um músculo relaxado pode ser estendido até certo comprimento, quando então oferece
resistência ao aumento do comprimento. Esta resistência caracteriza a existencia de um
componente elástico no músculo em repouso. No entanto, quando um músculo é estimulado
tetanicamente não se permitindo a mudança de comprimento (contração isométrica),
observa-se a situação de tensão máxima. A tensão varia muito conforme o estado do
músculo (relaxado, pouco contraído, muito contraído, contração máxima). No caso de
um músculo contraído ao máximo, a velocidade de contração é zero [peso infinito].
Quando diminuimos o peso aplicado ao músculo, existirá um peso no qual a velocidade de
contração pode ser observada (mas ainda é mínima e constante). Se o peso for
diminuído gradativamente (diminuindo assim a tensão exercida pelo músculo), a
velocidade de contração irá aumentando proporcionalmente (peso próximo de zero implica
em velocidade de contração máxima).
Contração isotônica: aquela em que a velocidade é diferente de zero e a tensão é
constante. A produção de calor por um músculo em contração isotônica é proporcional
à mudança de comprimento do músculo e não depende da velocidade de contração ou do
peso que foi levantado. Nas contrações isoméricas, onde não há alteração do
comprimento do músculo, existe a liberação de calor de manutenção. Esta quantidade de
calor é proporcional ao tamanho do músculo e corresponde à energia necessária para
manter a tensão.
Quando parte de um músculo está envolvido na manutenção da tensão, esta parte não
estaria necessariamente impedida de participar na geração de calor.
Estrutura Molecular:
Num músculo estriado esquelético típico, encontramos um eixo principal que liga os
dois tendões, presos ao osso a nível da articulação. As células musculares se
orientam ao longo deste eixo, são células multinucleadas envoltas individualmente por
tecido conjuntivo pelo qual chegam vasos capilares e nervos. O músculo contendo estas
células é envolvido por um tecido conjuntivo mais grosso.
Dentro das células musculares encontram-se feixes de estruturas quase tão longas
quanto a própria célula (miofibrilas). Na célula muscular podem ser observados dois
compartimentos individualizados: um contem miofribrilas, mitocôndrias e lisossomas. O
segundo, delimitado pelo retículo sarcoplasmático, não contem organelas.
A miofibrila apresenta uma alternância de bandas claras e escuras ao microscópio
óptico. As bandas claras não apresentam birrefringência e são portanto isotrópicas
(bandas I) e as bandas escuras, birrefringentes são anisotrópicas (bandas A). Esta
sequência de bandas se repete pela miofibrila ao longo do seu comprimento - cada unidade
é chamada sarcômero (vai da metade da banda I até a metade da banda I seguinte). Este
ponto de metade da banda I é marcado pela presença de um disco mais escuro, chamado
linha ou disco Z. Da mesma forma, na metada das bandas A existe um área de coloração
mais clara chamada banda H. A banda A é formada por miosina e a banda I por actina.
Esquematicamente:

músculo relaxado
O ATP é responsável pelo fornecimento de energia para a contração muscular.
Miofibrilas isoladas podem ser contraídas e observadas no microscópio comum na presença
de ATP. Durante a contração a banda I diminui de comprimento e a banda A permanece com
aproximadamente o mesmo comprimento. As bandas Z se aproximam.
Na ausência de ATP, a actina e a miosina permanecem ligadas. Na presença de ATP
ocorre hidrólise da junção [ponte] miosina/actina, a energia liberada por esta
hidrólise faz com que um filamento se desloque sobre o outro.
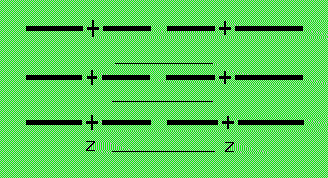
músculo contraído
Este modelo, chamado "filamentos deslizantes", propõe que o músculo se
contraia através do deslizamento de dois filamentos um sobre o outro, sem que nenhum dos
dois altere sua estrutura, composição química ou comprimento.
Na contração muscular isotônica observa-se uma diminuição no comprimento do
sarcômero e os filamentos tendem a se encontrar no centro da banda H. Neste ponto, existe
tensão máxima e não há como deslizar mais os filamentos, atingindo uma situação
isométrica. No caso da contração isométrica [tetânica], onde não observa
diminuição do comprimento do músculo, a energia liberada pelo ATP não pode ser
transformada em trabalho devido à incapacidade de deslizar mais os filamentos sobre os
outros e há produção de calor mas não de trabalho. A tensão seria então determinada
pelas pontes.
A quantidade de ATP hidrolisada é proporcional à reciclagem das pontes . Qaundo a
contração é realizada com alta velocidade e baixa tensão, a reciclagem de pontes é
alta e mais quantidade de ATP é necessária. À medida que a velocidade diminui, a
reciclagem de pontes é mais lenta e e menos ATP é consumido, mesmo que a tensão seja
aumentada.
Bases moleculares da pontes:
Miosina:
A miosina é uma molécula longa com uma cauda e duas cabeças. As cabeças podem se
mover em relação a si mesmas e em relação à cauda. Miosina pode ser separada por
enzimas proteolíticas em dois pontos diferentes. Se tratada com tripsina, a miosina é
dividida em meromiosina pesada [fragmento que retem a atividade ATPásica] e meromiosina
leve [que não possui atividade enzimática]. Meromiosina pesada é solúvel em baixas
concentrações de sal enquanto o fragmento meromiosina leve só é solúvel em
concentrações salinas bastante altas. A meromiosina pesada pode ainda ser clivada em
dois fragmentos pela papaína, um chamado subfragmento S-1 [que retem atividade ATPásica]
e o subfragmento S-2 sem atividade enzimática.
Para estudo dos polipeptídeos que compõem a estrutura quaternária da miosina, basta
romper as pontes dissulfeto e proceder a eletroforese para separação por peso molecular.
Existem duas cadeias pesadas na cauda e dois ou três pares de cadeias leves nas cabeças.
As cadeias leves estariam relacionadas à atividade ATPásica. O peso molecular e o
número destas cadeias leves variam de acordo com o músculo estudado e o tipo de fibras
[rápidas ou lentas].
Magnésio é o único cátion com efeito acelerador da atividade ATPásica da miosina.
O substrato realmente hidrolisado pela miosina parece ser Mg-ATP. A actina estimula de
forma significativa a hidrólise de ATP, e in vivo, a interação destas duas proteínas
deve ser o fenômeno responsável pela hidrólise do ATP durante uma contração.
Actina:
A actina é uma proteína globular com uma única cadeia polipeptídica e peso
molecular de 45KD. No estado monomérico (actina-G), possui uma molécula de ATP e uma de
cálcio incorporadas em sua estrutura. Em solução de alta força iônica, a actina se
polimerizará, ficando filamentosa com uma dupla fileira de monômeros enrolados sobre si
mesmos. Na passagem da forma monomérica para a forma filamentosa, o ATP é hidrolizado.
Actina/Miosina: se colocadas juntas numa solução, com o passar do tempo a solução
se torna mais viscosa [formação de complexos actina/miosina] e há aumento de fosfato
livre às custas da diminuição de ATP. O ADP formado é estável. A queda de ATP mantem
as moléculas de actina e miosina juntas e colocação de novo ATP na solução diminui
sua viscosidade.
Durante a contração e distensão de uma célula muscular não ocorre um deslizamento
livre sobre os dois tipos de filamentos. No relaxamento, uma lenta hidrólise de ATP
ocorre e mantem uma certa tensão entre os filamentos. Com a constante regeneração de
ATP, não se observa um estado de inextensibilidade das fibras musculares, a não ser nos
casos de rigor mortis, onde não existe novo influxo de ATP para o complexo. A
concentração de ATP se mantem constante devido à regeneração a partir de ADP e
fosfocreatina, reação catalisada pela creatinoquinase.
Uma fibra em contração isométrica em um dado comprimento, responde com mudança de
seu comprimento em alguns milisegundos, e se estabiliza na nova situação. A alteração
por que passa a tensão nesse tempo é chamada de um “transiente”. No transiente
observa-se que a tensão varia de forma linear com a mudança de comprimento, até atingir
um plateau.
Regulação da contração muscular:
Em 1947 foi demonstrado que a injeção de pequenas quantidades de Ca++ numa fibra
muscular desencadeava contração não só no local mas propagada por grande parte da
fibra. Devido ao curto tempo que se observa entre a despolarização da membrana
plasmática e a contração muscular, concluiu-se que não se tratava de um simples
processo de despolarização e difusão de íons pela membrana.
Atualmente sabe-se que com micropipetas suficientemente finas, pode-se estudar a
contração de determinados segmentos da fibra e estimular áreas tão restritas quanto
bandas A, I e Z, dependendo da especialidade do músculo e do animal em questão. A
membrana plasmática das fibras musculares é composta por um tubo cercado por duas
vesículas de retículo endoplasmático liso e que circunda toda as miofibrilas. Este
túbulo é o túbulo em T pois se coloca perpendicularmente à membrana plasmática.
O estímulo elétrico é levado ao interior da fibra muscular através dos túbulos e
as bolsas de Ca++ encontradas no interior do retículo estão tão próximas da unidade
contrátil que o espaço de tempo necessário entre o estímulo e a contração pode ser
explicado desta forma [e não por difusão de íons, conforme se pensava originalmente].
Terminada a onda de despolarização, o calcio é ativamente rebombeado para dentro do
retículoe o músculo relaxa. A regulação da contração muscular depende portanto do
nível de calcio nas miofibrilas e não da quantidade de ATP presente. Como a bomba de
calcio é ATP-dependente, conclui-se que mesmo o processo de relaxamento exige gasto de
energia.
Subunidades da Actina:
A actina pura na verdade não tem grande sensibilidade ao cálcio e foram as outras
moléculas isoladas de preparações purificadas de músculos que mostraram uma capacidade
maior de regulação pelo cálcio. Estas duas proteínas responsáveis pela sensibilidade
do complexo ao cálcio costumavam contaminar as preparações iniciais de actina, mas hoje
sabe-se que são proteínas independentes. A 1a destas proteínas é a tropomiosina
(filamentosa) e a segunda é a troponina (globular). A troponina pode ser dividida em 3
subunidades. A 1a, que apresenta ligações relativamente estáveis com a tropomiosina, é
chamada TN-T. A 2a subunidade tem grande capacidade de inibir a ATPase da actomiosina in
vitro e é chamada TN-I. A 3a subunidade tem como principal característica sua afinidade
com o cálcio e é denominada TN-C. Assim, cada molécula de troponina contem 3
subunidades, uma que mantem a ligação com a tropomiosina, outra que inibe as reações
da ATPase e outra responsável pela ligação com o calcio.
Acredita-se que nos sulcos formados entre duas fileiras de actina enroladas sobre si
mesmas, se coloquem moléculas de tropomiosina. Cada molécula de tropomiosina estaria em
contato com 7 moléculas de actina. Ligada a cada molécula de tropomiosina estaria uma
molécula de troponina. Na ausência de calcio, as subunidades TN-I e TN-T impediriam
(devido à sua localização) a ligação da actina e da miosina, impedindo assim a
contração muscular. Quando o calcio fosse liberado , ele se ligaria à subunidade TN-C
deslocando a molécula de tropomiosina. Assim estariam liberados os sítios de ligação
actina/miosina. Quando o calcio fosse rebombeado para o retículo sarcoplasmático, a TN-C
perderia sua ligação e a molécula de tropomiosina se deslocaria novamente agora
impedindo que os os sítios de ligação actina/miosina ficassem livres.
Este sistema de contração muscular estaria constantemente "armado" e por
isso a descarga elétrica desencadearia uma resposta tão rápida.
Em resumo:
| transmissão sináptica gera despolarização levada ao interior da fibra pelos túbulos
em T. | |
| liberação de calcio armazenado no interior de vesículas | |
| calcio + TN-C = alteração conformacional da troponina | |
| deslocamento da tropomiosina = libera os sítios de ligação actina/miosina | |
| bomba de calcio retorna o calcio para o retículo sarcoplasmático (uso de ATP) | |
| TN-C perde o calcio = troponina e tropomiosina retornam ao estado anterior |